抗癌药自然也不例外。
近日,来自西班牙的Nuria Lopez-Bigas团队在顶级期刊《自然·遗传学》上发表重要研究论文[1]。
他们从全基因组测序水平,分析了6种抗癌疗法(5个化疗,1个放疗)对3506个转移肿瘤的影响。找到了上述6种治疗方式在细胞DNA上留下的突变特征(简称“印迹”),还发现了一些放化疗药物会大幅加快DNA突变频率,最高能达到自然突变频率的100倍,甚至是1000倍。
此外,他们也评估了这些放化疗疗法对肿瘤突变负担的影响,以及可能给健康细胞带来的疾病驱动型变异风险。
研究人员认为,基于他们的发现,可以精确评估不同癌症疗法给DNA带来的突变风险,以了解它们的长期副作用。
 ▲Nuria Lopez-Bigas(图源:Wikipedia)
▲Nuria Lopez-Bigas(图源:Wikipedia)
使用了70余年的化疗,目前仍是很多原发肿瘤的主要且有效治疗手段。许多化疗会引起DNA损伤,选择性比较差,癌细胞和正常细胞都会遭殃。
虽然这些药物在大部分时候会杀死癌细胞或者正常细胞,但是仍有很多细胞“带伤”躲过一劫。那些出现在DNA上的伤,最终会转化成突变[1]。
也就是说,化疗药物会导致癌细胞和健康细胞出现基因突变。已经有很多研究表明,化疗引起的DNA突变,可能就是治疗之后给患者造成长期不良影响的基础[2-4],甚至是癌症卷土重来[5-7]。
用大白话说,化疗带来的基因突变,可能给患者带来不确定的健康隐患。
在患者从治疗中获益越来越持久的免疫治疗时代,这种潜在的安全隐患,再次将患者暴露于危险之中。对于那些从治疗中获得临床治愈的儿童癌症患者而言,这种影响就更不能忽视了。
Lopez-Bigas认为,之前在这个方面的研究是不够的,尤其是化疗对正常体细胞和生殖细胞的影响。
 ▲论文截图
▲论文截图
不过提出这个研究课题容易,做起来却是相当有难度。
为啥呢?
因为从整体上看,虽然放化疗对体细胞和生殖细胞有一定的影响,但是单从细胞的水平看,甚至是组织的层面看,都很难检测到这种影响。
这跟体细胞和生殖细胞与癌细胞增殖的方式不同有关。癌细胞是克隆扩增的,一旦出现突变,很容易就会被放大。但是体细胞和生殖细胞就没这技能,所以放化疗对它们的影响几乎是不可能检测得到的。
那咋办呢?
Lopez-Bigas团队把目光投向了那些接受过治疗的转移癌症患者。在研究人员看来,放化疗给细胞带来的DNA损伤以及基因突变,对于任何一个细胞而言都是独立的、类似的。而肿瘤细胞的克隆性扩增的特点,让检测这些突变成为可能。有了这个结果,就可以一窥放化疗对正常细胞的影响。
 ▲图源:www.sanger.ac.uk
▲图源:www.sanger.ac.uk
接下来的工作就是找合适的数据库,分析数据。
说来也巧。Lopez-Bigas团队看上了荷兰Hartwig医学基金会的一个癌症转移灶全基因组数据库[8]。
你们一定还记得,这个数据库就是我们11月6日推送的《癌症转移密码大起底!》那篇文章里提到的那个。其实,荷兰这个团队早在2018年就做出研究成果了,然后在bioRxiv上发了预印本,本月初发表在顶级期刊《自然》上了。(不得不说,我和这个数据库真是很有缘分呐~)
Lopez-Bigas团队从这个数据库中调取了3506个转移灶的全基因组测序数据。然后通过SignatureAnalyzer(v.4)[9,10]和SigProfiler(v.2.3)[11,12]两种方法,寻找突变特征。
6800多万个单碱基突变(SBS),近90万个双碱基突变(DBS)和1100多万个插入缺失突变标签分别被提取出来。当然,和一周前的研究一样,很多位点以前也被发现过。
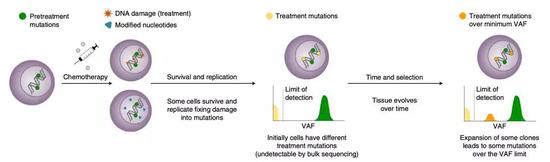 ▲研究过程
▲研究过程
突变的信息已经有了,接下来要获取的就是患者的治疗信息。据说,研究人员是手动整理了3500多名患者的治疗信息。
最终汇总出来,其中有2124个肿瘤样本是从接受过治疗的患者身上获取的,这些患者的治疗方式分布在58大类206种已获FDA批准的治疗方式之中。1848名患者用过其中两种及以上药物。
在获取患者的转移肿瘤组织之前,所有患者平均接受药物治疗2.33年。铂类药物(顺铂,卡铂和奥沙利铂)是这些患者最常使用的药物。
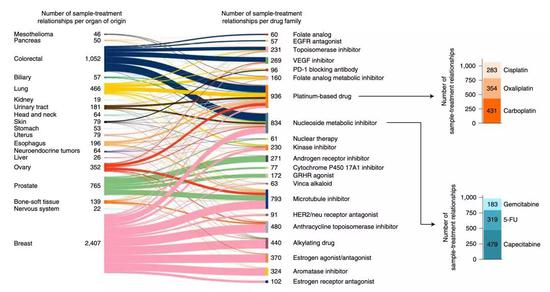 ▲不同的癌种和治疗方式
▲不同的癌种和治疗方式
初步分析治疗方式与变异标签之间的关系时,研究人员发现6种治疗方式有规律可循。
这治疗方式分别是:结合并破坏DNA的3种铂类药物(顺铂,卡铂和奥沙利铂),放疗,以及两种核苷代谢抑制剂——卡培他滨和5-氟尿嘧啶(5-FU)。
对于3种铂类药物而言,它们在患者体内留下的印记有:4个单碱基突变和2个双碱基突变。放疗有一个插入缺失突变标签。还在卡培他滨和5-氟尿嘧啶治疗的患者体内发现了一些全新的单碱基突变印迹。
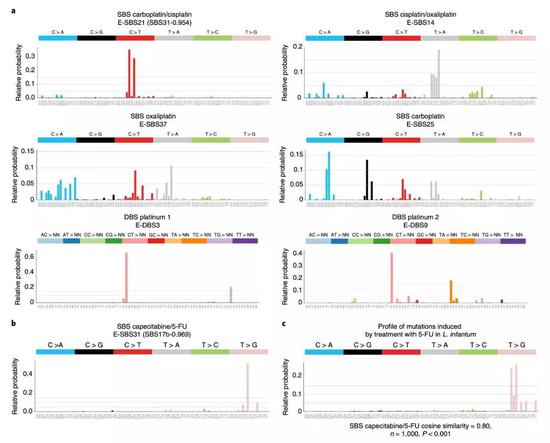 ▲变异类型大汇总
▲变异类型大汇总
为了进一步确定上述突变确实是放化疗带来的。研究人员又进一步假设:既然治疗相关的突变是药物带来的,那么从进化的角度讲,它们应该是在肿瘤发展的晚期才出现的。这是它们与内源自然突变的一大不同点。
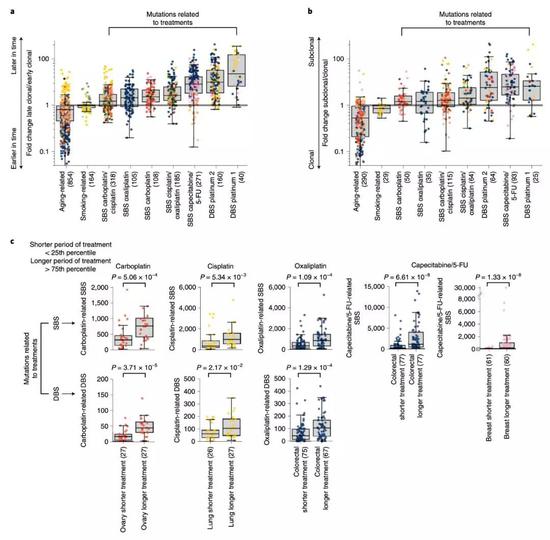
那从理论上讲,前面发现的突变都应该出现在晚期克隆中。根据2017年发表的计算方法[13],Lopez-Bigas团队又分析了一回数据。然后将发现的所有单碱基突变分成“早期克隆”或“晚期克隆”两类。
结果和他们预测的一样,那些与治疗相关的单碱基突变在“晚期克隆”中富集,而且倾向于出现在亚克隆之中。此外,研究人员还观察到,与治疗时间最短的四分之一患者相比,治疗时间最长的四分之一患者体内治疗相关的肿瘤突变负担更高。反观那些自然出现的突变,则没有这个特征。
以上的数据都指向一个事实,前面发现的突变印迹,确系治疗引起的。
二者之间的因果关系这就算是确定了。
 ▲治疗相关突变的特征
▲治疗相关突变的特征
那么治疗带来的变异对健康有哪些潜在的威胁呢?
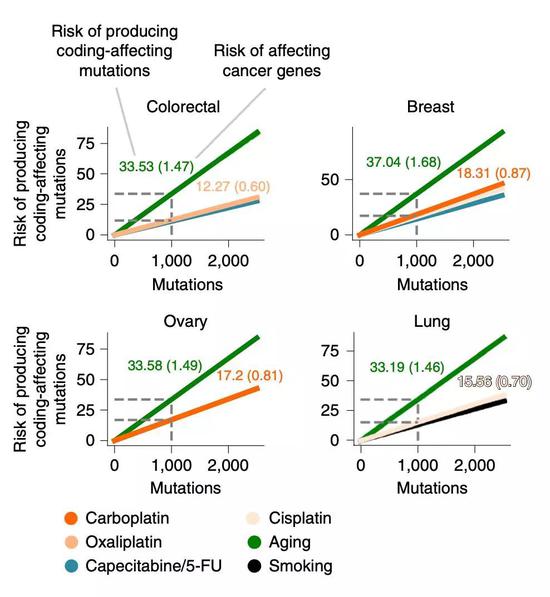
实际上,自然界发生的大部分突变对人体的影响是不大的。不过,要是突变改变了基因编码的蛋白,甚至影响到癌症相关基因的功能的话,那就非常危险了。
在后面的研究中,研究人员就将药物治疗带来的变异与自然突变做了个比较。
他们分析发现,在自然发生的每1000个突变中,有33.53个会影响基因的编码,1.47个会影响已知的癌症相关基因序列。而由奥沙利铂引起的1000个突变中,预计有12.27个会影响编码基因的序列,而只有0.6个会影响已知癌症基因的序列。
从数据的角度看,是不是感觉药物引起的变异好像也没啥~
 ▲不同的处理方式与突变的关系
▲不同的处理方式与突变的关系
厉不厉害,咱们得结合实际来看。
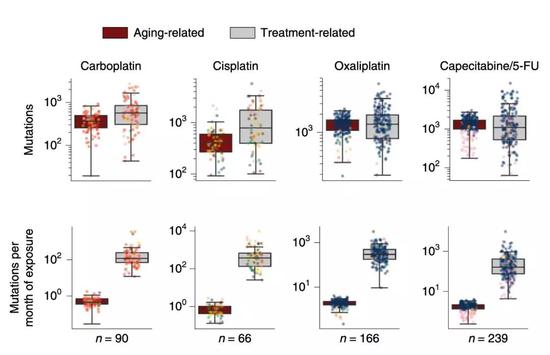
研究人员发现,用奥沙利铂治疗21周的肠道肿瘤,会出现20个治疗引起的影响基因编码的变异,其中有1个会影响到癌症相关基因的编码。而自然突变在这同一时期,只会带来1个影响基因编码的变异,以及0.01个影响癌症相关基因的突变。
同一时间内,二者相差了100倍。
而这种差异极有可能也反应在患者的健康体细胞或者生殖细胞上。
 ▲药物处理变异与自然变异之间的比较
▲药物处理变异与自然变异之间的比较
总的来说,在206种治疗方式中,研究人员只发现5种化疗和1个放疗,存在特定的基因突变印迹。研究人员认为,这背后有两个可能的原因。第一个是,其他的疗法不会直接破坏DNA;第二个是,他们的分析方式比较严格,一些不那么突出的关联极有可能被漏掉。
不过,研究人员认为,他们开发的这个方法可以用于一些大队列中,分析某种疗法与患者的突变之间的关系。
一旦我们知道了这种对应的相关性,不仅可以实现精准化疗,还可以控制好治疗的时间窗口,尽可能的降低治疗对患者的长期影响,这点对年轻的患者,尤其是儿童患者非常重要。

